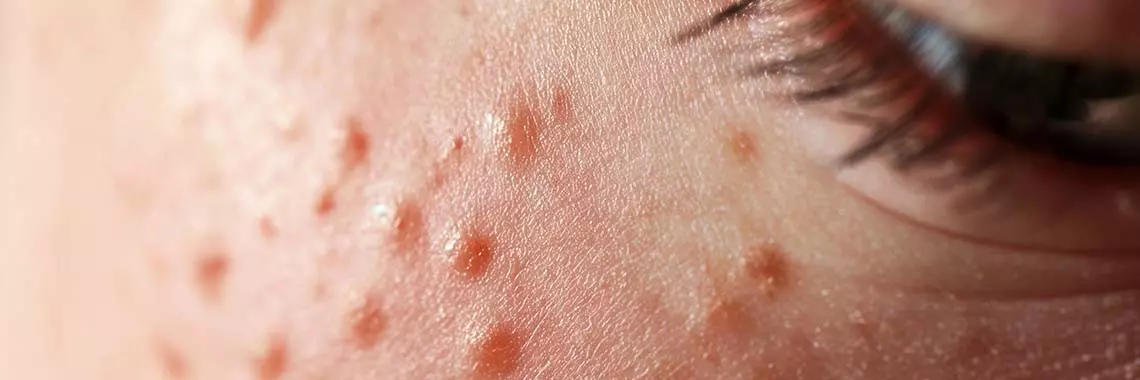
Brodawki wirusowe u dzieci
Brodawki wirusowe są bardzo częstymi infekcjami skóry u dzieci. Zmiany mogą być rozległe i powodować dolegliwości bólowe, stąd też konieczne jest włączenie skutecznego leczenia. Terapia brodawek wirusowych u dzieci jest niekiedy trudna i wymaga cierpliwości zarówno ze strony pacjenta, jak i lekarza.
Brodawki wirusowe są częstymi, łagodnymi nowotworami skóry powodowanymi przez wirus brodawczaka ludzkiego (Human Papillomavirus, HPV). Są wszechobecne w populacji ogólnej, ale częściej występują u dzieci. Infekcje HPV dotyczą nawet jednej trzeciej dzieci w wieku szkolnym [1–3]. Około dwie trzecie zmian ustępuje samoistnie, bez leczenia w ciągu 2 lat [4–5]. Wczesne włączenie leczenia jest ważne dla kontroli epidemiologicznej i zapobiegania rozprzestrzenianiu się wirusa na osoby z bliskiego kontaktu [6]. Nie ma jednak jak dotąd konsensusu co do najskuteczniejszej i najbezpieczniejszej opcji leczenia u dzieci.
Samoistne ustąpienie
Brodawki wirusowe mogą ustąpić samoistnie, zwłaszcza u dzieci z prawidłową odpornością [7]. Jednak proces ustępowania zmian może trwać nawet kilka lat. Należy poinformować opiekunów o czasie wymaganym do samowyleczenia, a także o ryzyku autoinokulacji w inne miejsca ciała i możliwości zakażenia innych osób podczas oczekiwania na ustąpienie zmian.
Krioterapia
Najczęstszym środkiem stosowanym w krioterapii jest ciekły azot o temperaturze −196°C. Techniki mogą różnić się sposobem aplikacji, czasem trwania leczenia i częstotliwością zabiegów. Technika natryskowa i aplikacja azotu wacikiem są najczęstszymi metodami aplikacji. Dwa badania wykazały, że obie metody są równie skuteczne [8–9]. Powinno się aplikować płynny azot do momentu, aż wokół obszaru docelowego utworzy się „halo lodowe” szerokości 1–2 mm.
Zazwyczaj trwa to 5–30 sekund. Proces rozmrażania trwa 15–30 sekund. Badanie wykazało, że drugi cykl zamrażania-rozmrażania może zwiększyć szybkość wyleczeń brodawek podeszwowych. Zalecany odstęp między każdą sesją wynosi 2–3 tygodnie. Według niektórych badań krioterapia jest znacznie bardziej skuteczna niż kwas salicylowy [10–11]. W przypadku brodawek hiperkeratotycznych, zwłaszcza dłoniowych lub podeszwowych, przed zastosowaniem krioterapii zaleca się użycie ostrza chirurgicznego, by usunąć zrogowacenia, co zwiększa skuteczność leczenia. Najczęstsze skutki uboczne krioterapii to ból i pojawienie się pęcherzy [11–12]. Ból najczęściej pojawia się podczas zabiegu, ale może również pojawić się kilka minut lub godzin po aplikacji. Metody zmniejszania bólu i dyskomfortu spowodowanego krioterapią obejmują stosowanie miejscowego środka znieczulającego (np. kremu EMLA) przed zabiegiem.
Kwas salicylowy
Kwas salicylowy (Salicylic Acid, SA) jest środkiem keratolitycznym stosowanym w leczeniu różnych schorzeń dermatologicznych. Jest również przydatny do miejscowej terapii brodawek wirusowych. Dostępne preparaty zawierają 20–30% SA. Zalecane stosowanie to 1–2 razy dziennie. Często zalecana jest nocna okluzja, np. taśmą klejącą po aplikacji. Kuracja SA wymaga czasu, leczenie może trwać kilka miesięcy. W niektórych przypadkach łączy się również kwas salicylowy z innymi środkami keratolitycznymi do stosowania miejscowego, na przykład SA z 5-fluorouracylem, SA z kwasem mlekowym i SA z kwasem glikolowym. Na podstawie badań opisujących stosowanie skojarzonych terapii miejscowych połączenie SA i kwasu glikolowego wydaje się najskuteczniejsze. Możliwe jest również łączenie preparatów SA z podofiliną, z krioterapią i z imikwimodem. Z działań ubocznych SA najczęściej obserwuje się podrażnienie skóry, wówczas zaleca się pacjentom przerwanie leczenia na kilka dni i powrót do leczenia po ustąpieniu podrażnienia [13–14].
Inne terapie miejscowe
Istnieją ograniczone dane dotyczące skuteczności i bezpieczeństwa innych miejscowych terapii stosowanych w leczeniu brodawek u dzieci. Chodzi o następujące substancje:
- roztwór formaliny,
- roztwór cynkowo-azotowy,
- kwas pirogronowy,
- kwas monochlorooctowy,
- azotan srebra,
- retinoidy miejscowe, np. adapalen,
- kantarydyna.
Skutecznym sposobem walki z brodawkami wirusowymi jest zastosowanie wyciągu roślinnego z glistnika jaskółcze ziele, który zawiera m.in. enzymy proteolityczne i fenolokwasy.
Zadaniem wymienionych substancji jest wywołanie stanu zapalnego i stymulacja układu odpornościowego skóry do walki z wirusem. Z działań ubocznych obserwowano objawy podrażnienia skóry w miejscu aplikacji preparatu, dolegliwości bólowe, pojawianie się pęcherzy. Objawy ustępowały w ciągu kilku dni. Ważne, żeby preparaty o działaniu drażniącym były aplikowane przez osobę dorosłą, z racji drażniącego charakteru substancji.
Immunoterapia
Immunoterapia wykorzystuje substancje do stymulacji lub tłumienia układu odpornościowego w leczeniu niektórych chorób. Immunoterapia stosowana w leczeniu brodawek obejmuje m.in. diphenylocyklopropenon (DPCP), imikwimod. Opisywane są doogniskowe iniekcje szczepionek MMR (odra, świnka, różyczka) czy BCG (Bacillus Calmette-Guérin). Uważa się, że zabiegi te stymulują układ odpornościowy do rozpoznawania i usuwania HPV. Przeprowadzone dotychczas badania objęły niewielką liczbę dzieci, stąd też immunoterapia nie jest aktualnie rekomendowana dla tej grupy wiekowej [15–17].
Cymetydyna – antagonista receptora H2 o działaniu immunomodulującym była stosowana w leczeniu brodawek u dzieci w kilku badaniach. Wskaźniki wyleczeń dla doustnej cymetydyny po 2–3 miesiącach leczenia wahały się od 52,9% do 56,3% przy dawkowaniu 25–40 mg/kg/dobę w 3–4 dawkach podzielonych. W Polsce lek ten nie jest dostępny. Uważa się również, że doustny siarczan cynku ma działanie immunomodulujące, ponieważ cynk jest mikroskładnikiem niezbędnym do prawidłowego funkcjonowania komórek odpornościowych [18].
Mechaniczne usuwanie brodawek wirusowych
Oprócz krioterapii, inne terapie mechaniczne, które zostały zbadane pod kątem leczenia brodawek skórnych u dzieci, obejmują łyżeczkowanie, elektrokoagulację, laseroterapię i powierzchowną radioterapię. Wymienione sposoby leczenia nie są odpowiednie do leczenia dzieci młodszych z uwagi na duże dolegliwości bólowe. Usunięcie chirurgiczne brodawki nie gwarantuje braku odrostu zmian w miejscu blizny.
Diagnostyka różnicowa
Diagnostyka różnicowa brodawek wirusowych u dzieci obejmuje modzele, znamiona naskórkowe, porokeratozę, włókniaki i inne łagodne lub złośliwe nowotwory. W przypadku podejrzenia niedoboru odporności konieczne są badania przesiewowe, które obejmują pełną morfologię krwi, stężenie składowych dopełniacza, stężenie immunoglobulin i badanie w kierunku zakażenia HIV.
Podsumowanie
Brodawki skórne są powszechne u dzieci i młodzieży. Często są one przyczyną dolegliwości bólowych. Samoistne ustąpienie wykwitów jest zjawiskiem rzadkim, stąd też konieczne jest włączenie leczenia, które będzie skuteczne i pozbawione działań ubocznych. Wydaje się, że u dzieci najlepszą opcją pozostają preparaty miejscowe.
Piśmiennictwo:
- Kwok C.S., Gibbs S., Bennett C., Holland R., Abbott R., Topical treatments for cutaneous warts, Cochrane Database Syst Rev. 9, 2012.
- De Koning M.N., Quint K.D., Bruggink S.C. et al., High prevalence of cutaneous warts in elementary school children and the ubiquitous presence of wart-associated human papillomavirus on clinically normal skin, Br J Dermatol. 172(1), 2015, 196–201.
- Van Haalen F.M., Bruggink S.C., Gussekloo J., Assendelft W.J.J., Eekhof J.A.H., Warts in primary schoolchildren: Prevalence and relation with environmental factors, Br J Dermatol. 161(1), 2009, 148–152.
- Lynch M.D., Cliffe J., Morris-Jones R., Management of cutaneous viral warts, Br Med J. 348, 2014, 3339.
- Bruggink S.C., Eekhof J.A.H., Egberts P.F., van Blijswijk S.C.E., Assendelft W.J.J., Gussekloo J., Natural course of cutaneous warts among primary school children: a prospective cohort study, Ann Fam Med. 11(5), 2013, 437–441.
- Steele K., Irwin W.G., Liquid nitrogen and salicylic/lactic acid paint in the treatment of cutaneous warts in general practice, J R Coll Gen Pract. 38(311), 1988, 256–258.
- Na C.H., Choi H., Song S.H., Kim M.S., Shin B.S., Two-year experience of using the measles, mumps and rubella vaccine as intralesional immunotherapy for warts, Clin Exp Dermatol. 39(5), 2014, 583–589.
- Bleiker T.O., Bourke J.F., Lear J., A comparison of cryogun versus cotton buds for the treatment of warts, Br J Dermatol. 137(Suppl. 50), 26(Abstract), 1997.
- Ahmed I., Agarwal S., Ilchyshyn A., Charles-Holmes S., Berth-Jones J., Liquid nitrogen cryotherapy of common warts: Cryo-spray vs. cotton wool bud., Br J Dermatol. 144(5), 2001, 1006–1009.
- Bruggink S.C., Gussekloo J., Berger M.Y. et al., Cryotherapy with liquid nitrogen versus topical salicylic acid application for cutaneous warts in primary care: Randomized controlled trial, CMAJ 182(15), 2010, 1624–1630.
- Bruggink S.C., Gussekloo J., Egberts P.F. et al., Monochloroacetic acid application is an effective alternative to cryotherapy for common and plantar warts in primary care: A randomized controlled trial, J Investig Dermatol. 135(5), 2015, 1261–1267.
- Gupta R., Gupta S., Topical adapalene in the treatment of plantar warts; randomized comparative open trial in comparison with cryotherapy, Indian J Dermatol. 60(1), 2015, 102.
- Rodríguez-Cerdeira C., Sánchez-Blanco E., Glycolic acid 15% plus salicylic acid 2%: A new therapeutic pearl for facial flat warts, J Clin Aesthet Dermatol. 4(9), 2011, 62–64.
- Van Brederode R.L., Engel E.D., Combined cryotherapy/70% salicylic acid treatment for plantar verrucae, J Foot Ankle Surg. 40(1), 2001, 36–41.
- Salem A., Nofal A., Hosny D., Treatment of common and plane warts in children with topical viable bacillus calmette-guerin, Pediatr Dermatol. 30(1), 2013, 60–63.
- Silverberg N.B., Lim J.K., Paller A.S., Mancini A.J., Squaric acid immunotherapy for warts in children, J Am Acad Dermatol. 42(5), 2000, 803–808.
- Maronn M., Salm C., Lyon V., Galbraith S., One-year experience with candida antigen immunotherapy for warts and molluscum, Pediatr Dermatol. 25(2), 2008, 189–192.
- Yilmaz E., Alpsoy E., Basaran E. Cimetidine therapy for warts: a placebo-controlled, double-blind study, J Am Acad Dermatol. 34(6), 1996, 1005–1007.